Локальный микробиологический мониторинг в медицинской организации: что предлагают разные руководства и где они противоречат друг другу?
Содержание
Общая информация
Статья: «Сравнительный анализ методологий мониторинга антимикробной резистентности в контексте локального уровня здравоохранения»
Авторы: Гультяева Н.А., Виноградова А.Г., Кузьменков А.Ю.
Журнал: Клиническая микробиология и антимикробная химиотерапия (КМАХ), 2025, том 27, №2, стр. 181–205
DOI: 10.36488/cmac.2025.2.181-205
Тип: обзорная статья
Главная идея работы: локальный мониторинг АМР нужен не “вообще”, а под конкретную цель (эмпирическая АМТ, инфекционный контроль, аналитика вмешательств и т.д.). Если цель не задана, то разные “правильные” методики начинают давать разные цифры — и приводят к разным управленческим решениям.
Скачать материалы
- PDF статьи:
⬇️ Скачать PDF
Ссылка для цитирования
Гультяева Н.А., Виноградова А.Г., Кузьменков А.Ю. Сравнительный анализ методологий мониторинга антимикробной резистентности в контексте локального уровня здравоохранения. КМАХ. 2025;27(2):181–205. DOI: 10.36488/cmac.2025.2.181-205
Что именно сравнили авторы
Авторы сопоставили подходы пяти документов (и их доступные версии), которые часто используют как основу для мониторинга АМР на уровне медицинской организации:
- WHO GLASS: GLASS manual for antimicrobial resistance surveillance…
- CLSI M39 (4-е изд.): Analysis and Presentation of Cumulative Antimicrobial Susceptibility Test Data…
- ESCMID: European recommendations for antimicrobial resistance surveillance
- Практическое руководство по мониторингу антибиотикорезистентности с использованием платформы AMRcloud
- МР 3.1.0346-24: «Организация и проведение микробиологического мониторинга в медицинских организациях»
Метод: 12 “контрольных вопросов”, по которым сравнивали документы
Сравнение проводилось как поиск ответов на заранее сформированный перечень из 12 вопросов, которые покрывают ключевые элементы локального мониторинга:
- Что включает понятие микробиологического мониторинга / мониторинга АМР?
- Какую цель преследует мониторинг АМР?
- Каковы критерии включения случая наблюдения (единицы наблюдения) в набор данных?
- Какие дополнительные параметры (метаданные) включать в набор данных?
- Каков минимальный/рекомендуемый размер выборки для репрезентативных результатов?
- Что делать с повторными изолятами (дублями) от одного пациента?
- Можно ли включать скрининговые/неклинические изоляты в мониторинг?
- Какие требования к качеству/формату/валидации данных нужны перед анализом?
- Как часто публиковать отчёты и доводить результаты до пользователей?
- В какой форме предоставлять отчёт (таблицы/графики/стратификация)?
- Какие инструменты (ПО) доступны для накопления, анализа и отчётности?
- Как применять результаты для эмпирической АМТ и управленческих решений?
Ключевые результаты и практические выводы
1) Термины и “границы мониторинга” отличаются — и это уже влияет на дизайн данных
Даже определения “мониторинга АМР” заметно расходятся. Важное наблюдение авторов: расхождения терминологии легко превращаются в расхождения целей, а значит — в разные правила включения/исключения данных.
В МР 3.1.0346-24 вводится деление мониторинга на плановый и внеплановый, хотя в большинстве подходов мониторинг понимается как непрерывная система (а “внеплановое” корректнее трактовать как усиленный режим при эпидсигналах). Также МР расширяют источники данных за счёт неклинических образцов (скрининг, окружающая среда и т.п.), что спорно для задач локальных алгоритмов эмпирической АМТ: такие данные смещают оценки резистентности и не отражают клинически значимые инфекции. Практически это решается разделением контуров: клинические диагностические изоляты — для эАМТ, а скрининг и среда — отдельно для инфекционного контроля. Такой подход впервые предлагается в “Практическое руководство по мониторингу антибиотикорезистентности с использованием платформы AMRcloud”
2) Цель мониторинга диктует всё остальное
Для “локального уровня” авторы обсуждают как минимум два крупных класса целей:
- клинические (пациент-ориентированные) — поддержка эмпирической терапии и закупка антимикробных препаратов;
- инфекционная безопасность/инфекционный контроль (патоген-ориентированные) — понимание передачи и распространения (в т.ч. клонов высокого риска).
Именно поэтому один и тот же набор лабораторных данных может быть “правильным” для отчёта по инфекционному контролю — и неподходящим для выбора эмпирической терапии.
3) Единица наблюдения: “изолят” vs “случай инфекции” — это разные миры
В обзоре выделяются подходы:
- изолят-ориентированный (чаще проще организационно, но больше статистических смещений);
- образец-ориентированный;
- синдром-/случай-ориентированный (проспективный, “по эпизодам инфекции”).
Ключевой тезис: для задач эмпирической терапии и оценки эффекта вмешательств случай-ориентированный подход выглядит более объективным, потому что позволяет работать с клиническими знаменателями и метаданными, но он дороже и требует обучения и процессов на стороне клиники.
4) Метаданные решают: без них локальная эпидемиология “не клиническая”
Документы по-разному задают минимальный набор дополнительных полей (контекст пациента, отделение, локус инфекции, происхождение инфекции и т.д.). Авторы отдельно подчеркивают: единого “минимального списка” метаданных не прослеживается, а без них мониторинг слабо “приземляется"“на клинические решения.
5) Репрезентативность: порог “≥ 30 изолятов” часто становится практическим минимумом
В части, посвящённой выборке, приводится практическое правило из CLSI M39: в отчёт рекомендуется включать виды, по которым набирается не менее 30 изолятов за период; при меньшем числе предлагаются варианты (публикация с оговорками, укрупнение, увеличение окна наблюдения и т.п.).
Это важно, потому что “частые отчёты” при малых числах дают иллюзию точности и провоцируют неверные выводы.
6) Повторные изоляты (дубли): без дедупликации оценка резистентности искажается
Сравнение подходов к дублям — один из самых прикладных результатов статьи:
- CLSI M39-A4: включать только первый изолят каждого вида от пациента за период наблюдения — независимо от локуса и фенотипа.
- ESCMID: дедупликация возможна по-разному (первый изолят; по фенотипу; по окну 7/30 дней и т.д.), при этом подчёркивается, что информацию о дублях не стоит удалять из ЛИС, т.к. она может быть полезна для анализа конкретного пациента.
- AMRcloud (руководство): рекомендует исключать и дубли, и повторные изоляты; оптимальным считает включение первого изолята.
- МР 3.1.0346-24: не даёт рекомендаций по тактике работы с повторными изолятами.
Практический смысл: тяжёлым пациентам чаще берут посевы повторно, поэтому без дедупликации мониторинг закономерно смещается в сторону более резистентных профилей.
7) Скрининг/неклинические изоляты: для эмпирической терапии их нельзя “мешать” с клиническими
В обзоре показано, что GLASS и CLSI M39 ориентируются на клинические изоляты (скрининг и неклинические образцы не должны попадать в основной набор). Руководство AMRcloud также подчёркивает ценность клинически значимых изолятов для протоколов эАМТ и необходимость раздельного анализа клинических и колонизирующих изолятов.
При этом МР 3.1.0346-24 допускают работу с неклиническими источниками (в логике санитарной микробиологии), что полезно для инфекционной безопасности, но искажает картину, если использовать такие данные для “локальной антибиотикограммы” под эмпирическое лечение (скрининг часто делается селективными методами под резистентные фенотипы).
8) Качество данных: актуальные критерии, валидация и “экспертные правила” — обязательны
GLASS подчёркивает надлежащую лабораторную практику и необходимость использовать актуальные критерии интерпретации (EUCAST/CLSI). CLSI M39 делает акцент на том, что в отчёт должны попадать окончательные верифицированные результаты и что ЛИС/экспертные системы должны помогать выявлять “маловероятные” профили и несоответствия.
С практической точки зрения: без единых справочников, контроля версий критериев, проверок формата и логики данных мониторинг превращается в “красивые, но ненадёжные” графики.
9) Периодичность отчётов: чаще — не всегда лучше
Большинство подходов сходятся на ежегодной отчётности как “базовой”, с допущением более частых отчётов при достаточной мощности данных. МР 3.1.0346-24 рекомендуют ежемесячные/квартальные/годовые отчёты (в логике санитарной микробиологии).
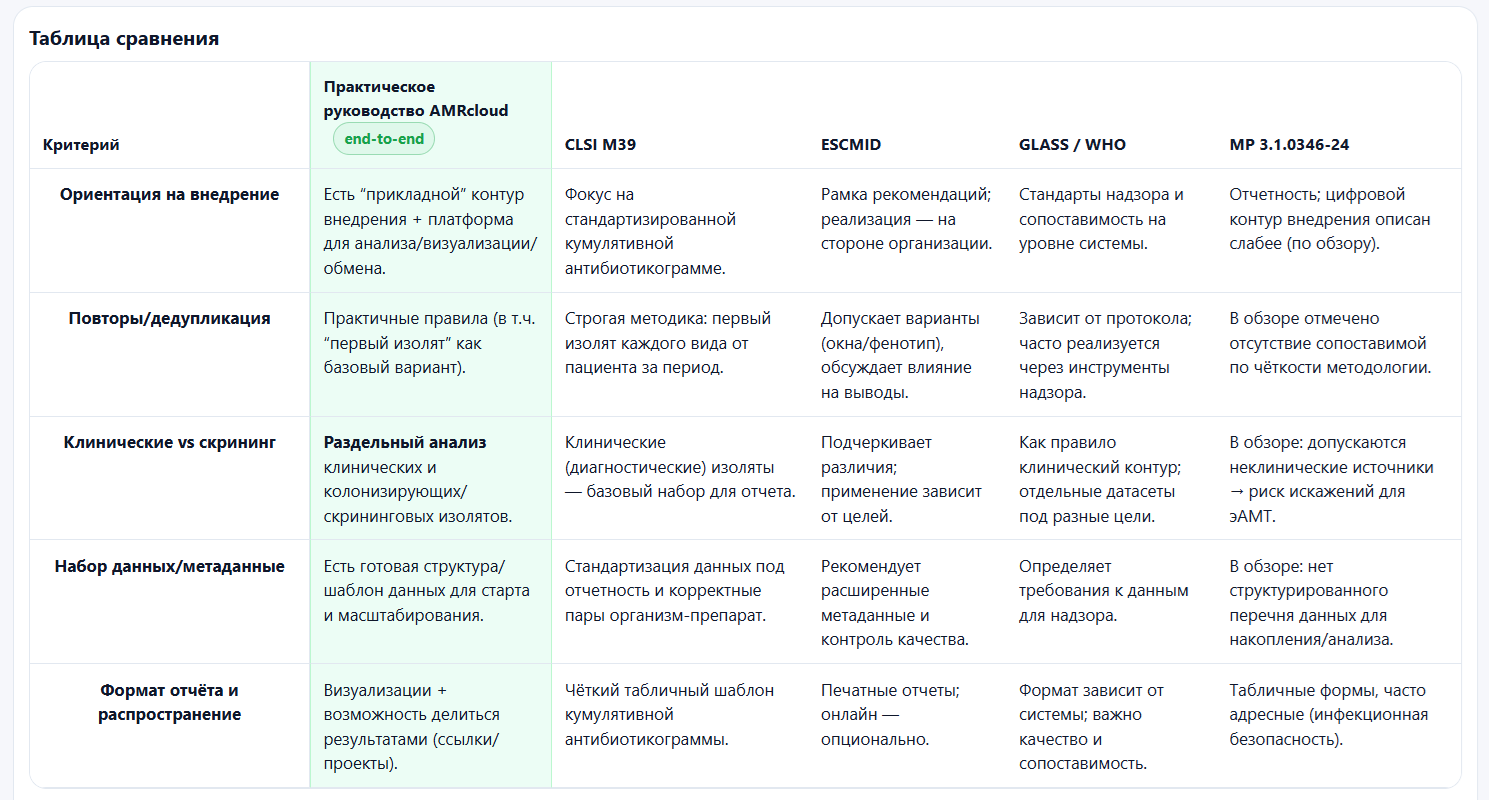
10) Формат отчёта: CLSI даёт чёткий шаблон антибиотикограммы, МР — таблицы, AMRcloud — визуализации
Один из самых прикладных фрагментов обзора — сравнение форм отчётности:
- CLSI M39-A4: классическая табличная кумулятивная антибиотикограмма (вид × препарат, % чувствительных), обязательные поля (период, место, число изолятов, методология), допустимы стратификации (например, моча; отделения; группы пациентов).
- AMRcloud: форма отчёта на усмотрение пользователя, но подробно описаны готовые графические формы и возможность делиться проектами/графиками по ссылке.
- МР 3.1.0346-24: табличная форма (приложение) с расчётами (включая отрицательные пробы, доли MRSA/VRE/БЛРС/карбапенемаз и др.), сложная стратификация по отделениям и биоматериалу; отчёт адресован узкому кругу лиц по инфекционной безопасности.
Что важно “вынести в практику” (короткий чек-лист для медицинской организации)
- Сформулировать цель локального мониторинга (эАМТ/санбак/оба — но с раздельными наборами и отчётами).
- Зафиксировать единицу наблюдения и критерии включения (изолят/эпизод инфекции/образец).
- Определить и задокументировать дедупликацию (например, “первый изолят вида на пациента за период”).
- Разделять клинические и скрининговые/колонизирующие изоляты (не смешивать для протоколов эАМТ).
- Утвердить минимальный набор метаданных (отделение, локус, происхождение инфекции и т.д.).
- Встроить контроль качества данных (форматы, справочники, актуальные EUCAST/CLSI, логические проверки, “экспертные правила”).
- Выбрать периодичность по мощности данных (ежегодно как базово; чаще — только при достаточных числах).
- Сделать отчёт читаемым и доступным (таблицы + понятные визуализации + стратификация под клинические сценарии).
Итоговая таблица: что лучше подходит для локальной эпидемиологии и протоколов эАМТ
| Вопрос | Руководство AMRcloud (практика/внедрение) | CLSI M39 | ESCMID | GLASS / WHO | МР 3.1.0346-24 (ограничения для эАМТ) |
|---|---|---|---|---|---|
| Фокус и “приземление” на клинику | Прямо ориентирует на использование данных для протоколов/формуляров и решений в медицинской организации; поддерживает управляемый контур данных и визуализации | Кумулятивная антибиотикограмма как инструмент эмпирической терапии | Общие рекомендации по локальной АМР-аналитике и использованию | Стандартизация и сопоставимость на уровне систем надзора | Сильнее “санбак-логика”; для клинических алгоритмов эАМТ требует серьёзных уточнений |
| Клинические vs неклинические образцы | Подчёркивает ценность клинически значимых изолятов; неклинические (скрининг/колонизация) — раздельно | Требует различать цель культуры (диагностика/скрининг/надзор) | Требует различать клинические и скрининговые культуры | Ориентация на клинические данные пациентов/случаев | Допускает включение неклинических источников; в обзоре отмечена дискуссионность для построения локальных алгоритмов эАМТ |
| Дедупликация / повторы | Делает акцент на управлении дублями и корректности аналитики; логика “первого изолята” как практичный базис | Сильная, формализованная методика (включение первого изолята и др.) | Обсуждает варианты дедупликации и влияние на выводы | Зависит от цели/типа мониторинга | В обзоре отмечено отсутствие сопоставимой по чёткости методологии дедупликации (как отдельного блока правил) |
| Набор данных и метаданные | Даёт структурированный шаблон (группы данных) и допускает расширение; удобно для старта и стандартизации | Делит поля на обязательные/желаемые; ожидает интеграции ЛИС/ЭМК | Опирается на расширенный набор полей и знаменатели | Для разных подходов — разные датасеты | В обзоре подчёркнуто: нет структурированного перечня для накопления/анализа, что осложняет воспроизводимую аналитику |
| Качество данных и валидация | Практическая ориентация на очистку/стандартизацию справочников и корректный формат данных; подходит для “реальной” ЛИС-рутины | Упор на стандартизацию и поддержку “экспертными” функциями ЛИС | Упоминает экспертные системы (обобщённо) | Требует надлежащей практики и актуальных правил интерпретации | Много про отчётные формы, меньше про конкретные механики контроля качества/валидации данных в цифровом контуре (по обзору) |
| Периодичность | Оставляет выбор частоты медицинской организации (реалистично при малых n) | Обычно ежегодно; чаще при достаточной мощности | Ежегодно как минимум; чаще при достаточной мощности | Обычно 1 год | Предлагает ежемесячно/квартально/год — но при малых выборках это может давать нестабильные оценки для эАМТ |
| Форма отчёта / доступность | Интерактивные дашборды, проекты и ссылки; быстро доводится до клиницистов/локальной команды | Стандартизированная таблица кумулятивной антибиотикограммы + стратификации | Понятные печатные отчёты; онлайн — опционально | На локальный формат влияет выбранная система | Отчёт адресован узкому кругу, “не для широкого распространения”; при этом для клиницистов/эАМТ часто нужна доступность и читаемость |
| Инструменты/внедрение | Готовое ПО + сценарии импорта из ЛИС/МИС/Excel | Обычно ЛИС/ЭМК + Excel/WHONET | Упоминание ПО без конкретики | WHONET (+ BACLINK) | Ставка на ЛИС, но без явной “дорожной карты” цифрового внедрения (по обзору) |
| Пригодность для локальных алгоритмов эАМТ | Высокая: клиническая ориентация, разделение потоков данных, удобная аналитика | Высокая (как “золотой стандарт” кумулятивных антибиотикограмм) | Средняя/высокая (больше принципов, меньше конкретных процедур) | Высокая для стандартизации надзора | Ограниченная без оговорок: смешение неклинических источников и слабее описанные правила данных/дедупликации делают документ менее удобным именно для протоколов эАМТ |